《化学平衡状态》福建西山学校高中部高二化学优秀教案
2013-12-16 18:13:08 来源: 点击:
| 课题(二) | 化学平衡状态 | |||
| 主稿:郭伟军 | 审核:任丽丽 | 日期:13年 月 日 星期 | ||
| 知识与技能: |
1、认识可逆反应的限度,建立化学平衡的观点;
2、理解化学平衡是相对的、有条件的、动态的,树立辩证唯物主义观点。
|
|||
| 过程与方法: | 采用科学探究的方法,提出问题,引导学生讨论、总结,培养学生分析问题和解决问题的能力。 | |||
| 情感价值观 | 从实际生产中出现的问题,激发学生研究化学平衡的兴趣。 | |||
| 教学重点: | 化学平衡的建立与特征。 | |||
| 教学难点 | 化学平衡的建立 | |||
| 教学过程: | 备注: | |||
| 【新课引入】 创设情境,激发兴趣。在19世纪后期,人们发现从炼铁高炉炉口排出的尾气中含有一定量的CO,有的工程师认为,这是由于CO和铁矿石的接触时间不够长的原因。于是在英国耗费了大量资金建造了一个高大的炼铁高炉,以增加CO和铁矿石的接触时间。可后来发现,用这个高炉炼铁,排出的高炉气中CO的含量并没有减少。 【学生】产生疑问 (1)为什么炼铁高炉中Fe2O3+3CO 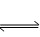 2Fe+3CO2的反应不能进行到底? 2Fe+3CO2的反应不能进行到底?(2)为什么增加CO和铁矿石的接触时间不能减少高炉气中CO的含量? 【教师】引导学生展开讨论,并得到结论 反应Fe2O3+3CO  2Fe+3CO2是可逆反应,特点是高温下既能向正反应方向进行又能向逆反应方向进行。 2Fe+3CO2是可逆反应,特点是高温下既能向正反应方向进行又能向逆反应方向进行。【思考】什么是可逆反应?可逆反应有何特点? 一、可逆反应 1、在相同条件下同时向正、反两个方向进行的反应称可逆反应。 2、可逆反应的特点: ①相同条件下,正反应和逆反应同时发生 ②可逆反应有一定的限度(反应不能进行到底),反应物、生成物共同存在 【练习】判断下列反应是否是可逆反应? 略,见课件。 【教师】化学平衡是如何实现的呢?中间经历了怎样的过程? 【学生】随着时间的变化,反应物的浓度逐渐减小,生成物的浓度逐渐增大,同时正反应速率逐渐减小,逆反应速率逐渐增大,当正、逆反应速率相等时,反应物、生成物的浓度不再发生变化。 二、化学平衡状态 1、在一定条件下,可逆反应里正、逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。 【思考】化学平衡状态和化学反应的限度是什么关系呢? 【引导】当反应达到化学平衡状态时,反应物浓度减少到最小值,生成物浓度增加到最大值 【学生】当反应达到化学平衡状态时,反应物最大程度地转变成了生成物,即达到了化学反应的限度,反应物达到了最大转化率。 2、特征 逆——化学平衡研究的对象是可逆反应; 等——V正==V逆 ; 动——化学平衡是动态平衡,V正与V逆都不为0; 定——各组分浓度及分数一定; 变——条件改变,平衡会被破坏。 【练习】判断下列反应是否达到化学平衡状态? 略,见课件。 【教师】那么,如何判断一个可逆反应是否达到了平衡状态呢?达到化学平衡有什么标志? 3、达到化学平衡的标志 (1)等速标志:对于同一种反应物或生成物,其V正==V逆; (2)恒浓标志:反应混合物中各组分的浓度或含量保持不变。 小结: 作业:活页第二课时 |
||||
上一篇:《化学反应的方向》福建西山学校高中部高二化学优秀教案
下一篇:《化学平衡常数》福建西山学校高中部高二化学优秀教案
 全国统一免费咨询热线:400-66-52373(欢迎来电咨询!)
全国统一免费咨询热线:400-66-52373(欢迎来电咨询!)